
خلية أسيتات البوليفينيل أو “غراء PVA” غالباً ما يرتبط بمشاريع المدارس وأنشطة النجارة. قد يكون أحد المكونات الرئيسية في إنتاجه يتمتع بقدرة طبية خفية في علاج السرطان، وفقًا لدراسة أجرتها جامعة طوكيو في اليابان.
على وجه التحديد، فإن إضافة مركب كحول البوليفينيل إلى مزيج العلاج الإشعاعي المستخدم في علاج سرطانات الرأس والعنق يحسن استهداف خلايا الورم، تاركاً الخلايا السليمة بأضرار أقل.
“اكتشفنا أن [كحول البوليفينيل]، المستخدم في الغراء السائل، يحسن بشكل كبير فعالية مركب يسمى D-BPA، والذي كان يُستبعد حتى الآن من مكونات الأدوية لأنه كان يُعتبر عديم الفائدة”، يقول كبير مؤلفي الدراسة تاكاهيرو نوموتو، مهندس حيوي من جامعة طوكيو.

يتطلب علاج السرطان علاج التقاط النيوترونات بالبورون (BNCT) أن يتلقى المرضى دواءً يُحمّل خلايا الورم بعنصر البورون، والذي يمتص جرعة من النيوترونات ويتحلل بانفجار إشعاعي، مما يؤدي إلى قتل الخلايا المحيطة.
وبينما يُعد هذا الاستهداف الدقيق فعالاً، إلا أن تيار النيوترونات منخفض الطاقة لا يمكن نشره إلا في الأورام القريبة من سطح الجلد. كما أن مدى احتفاظ البورون في خلايا الورم يؤثر أيضاً على فعاليته.
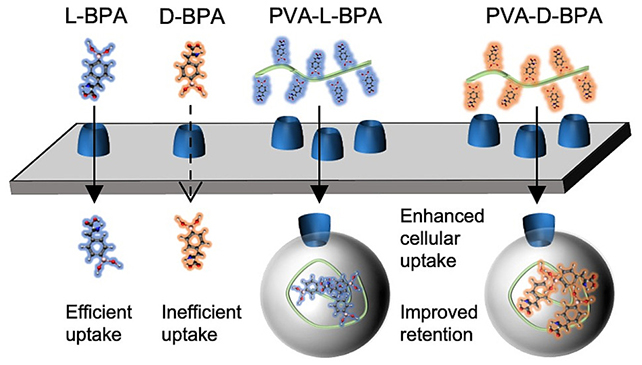
بإضافة كحول البولي فينيل، تمكن الباحثون سابقا من تحسين فعالية مكون أساسي في الدواء يسمى L-BPA.
ومع ذلك، يمكن أن يدخل L-BPA أيضًا الخلايا السليمة في بعض الحالات، مما دفع الباحثين إلى توجيه انتباههم إلى مادة مشابهة تسمى D-BPA.
على عكس L-BPA، لا يتراكم D-BPA في خلايا السرطان، وهذا هو السبب في عدم استخدامه سابقًا في علاج السرطان. ومع ذلك، عند دمجه مع كحول البولي فينيل، أظهر D-BPA أنه أفضل من L-BPA في تجميع البورون في الأورام والحفاظ عليه في مكانه.
“في نموذج ورم تحت الجلد، حقق هذا النظام تراكمًا انتقائيًا للورم مرتفعًا بشكل مدهش لم يكن من الممكن تحقيقه بالطرق التقليدية، وحفز آثار BNCT جذرية”، يكتب الباحثون في ورقتهم المنشورة.
“قد يكون كحول البولي فينيل مادة فريدة من نوعها لإطلاق إمكانات الجزيئات الخاملة ظاهريًا.”
يلزم إجراء المزيد من البحوث لإثبات نجاح هذا في علاجات [[LINK10]] العلاج الإشعاعي [[LINK10]] الفعلية، ولكن اختبارات المختبر واعدة. إذا كان هناك المزيد من البورون داخل خلايا السرطان، واستمر لفترة أطول، فيجب أن تؤدي تيارات النيوترونات إلى تدمير الأنسجة السرطانية بمعدل أسرع، مما يجعل العلاجات أقصر وتسبب ضررًا جانبيًا أقل.
يقول [[LINK11]] نوموتو [[LINK11]]: “هناك العديد من المتطلبات في تطوير أدوية لعلاج السرطان، وقد ركزت الكثير من البحوث والتطوير الحديثة على تركيبات معقدة من الجزيئات باهظة الثمن.”
“ومع ذلك، نحن قلقون من أن هذه الأساليب، عند تطبيقها عمليًا، ستكون باهظة الثمن لدرجة أن عدداً محدوداً فقط من المرضى سيستفيدون. في هذه الدراسة، هدفنا هو تطوير دواء بسيط التركيب وعالي الوظائف بتكلفة منخفضة.”
نُشِرَ البحثُ في مجلة Journal of Controlled Release.