هذه بداية مقال أطول. المحتوى: “
A curious link بين مرض ألزهايمر ومقاومة الأنسولين أصبح الآن راسخًا للغاية، لدرجة أن مرض التنكس العصبي يُطلق عليه أحيانًا type III diabetes.
الآن، حقن أنفي طورّه باحثون إيطاليون للاستفادة من هذه العلاقة قدّم نتائج واعدة في إيقاف تدهور الدماغ لدى الفئران المعدلة وراثيًا لتصبح عرضة لحالة مشابهة لمرض ألزهايمر.
وجدت عالمة وظائف الأعضاء فرانشيسكا ناتالي وزملاؤها في جامعة ميلانو الكاثوليكية زيادة في إنزيم رئيسي في أدمغة مرضى ألزهايمر بعد الوفاة يسمى S-acyltransferase.
”
أظهرت الأبحاث السابقة أن مقاومة الأنسولين يمكن أن تؤثر على كمية إنزيمات أسيل ترانسفيراز هذه في الدماغ. عادةً ما يربط الإنزيم جزيئات الأحماض الدهنية بتجمعات بيتا أميلويد وبروتين تاو المشبوهة سيئ السمعة، على الرغم من أنه في الأفراد الذين يعانون من [[LINK11]]تدهور يعتمد على مقاومة الأنسولين في الدماغ (BIR) [[LINK11]]، قد تخرج هذه العملية عن نطاق السيطرة.
أظهرنا في هذه الدراسة الجديدة أنه في المراحل المبكرة من مرض الزهايمر، تتسبب التغيرات الجزيئية التي تشبه سيناريو مقاومة الأنسولين في الدماغ في زيادة مستويات إنزيم أسيل ترانسفيراز، يقول عالم الأعصاب سالفاتور فوسكو، موضحاً كيف تؤدي هذه الإنزيمات بعد ذلك إلى تغيير الوظيفة الإدراكية والتراكمات غير الطبيعية للكتل البروتينية.
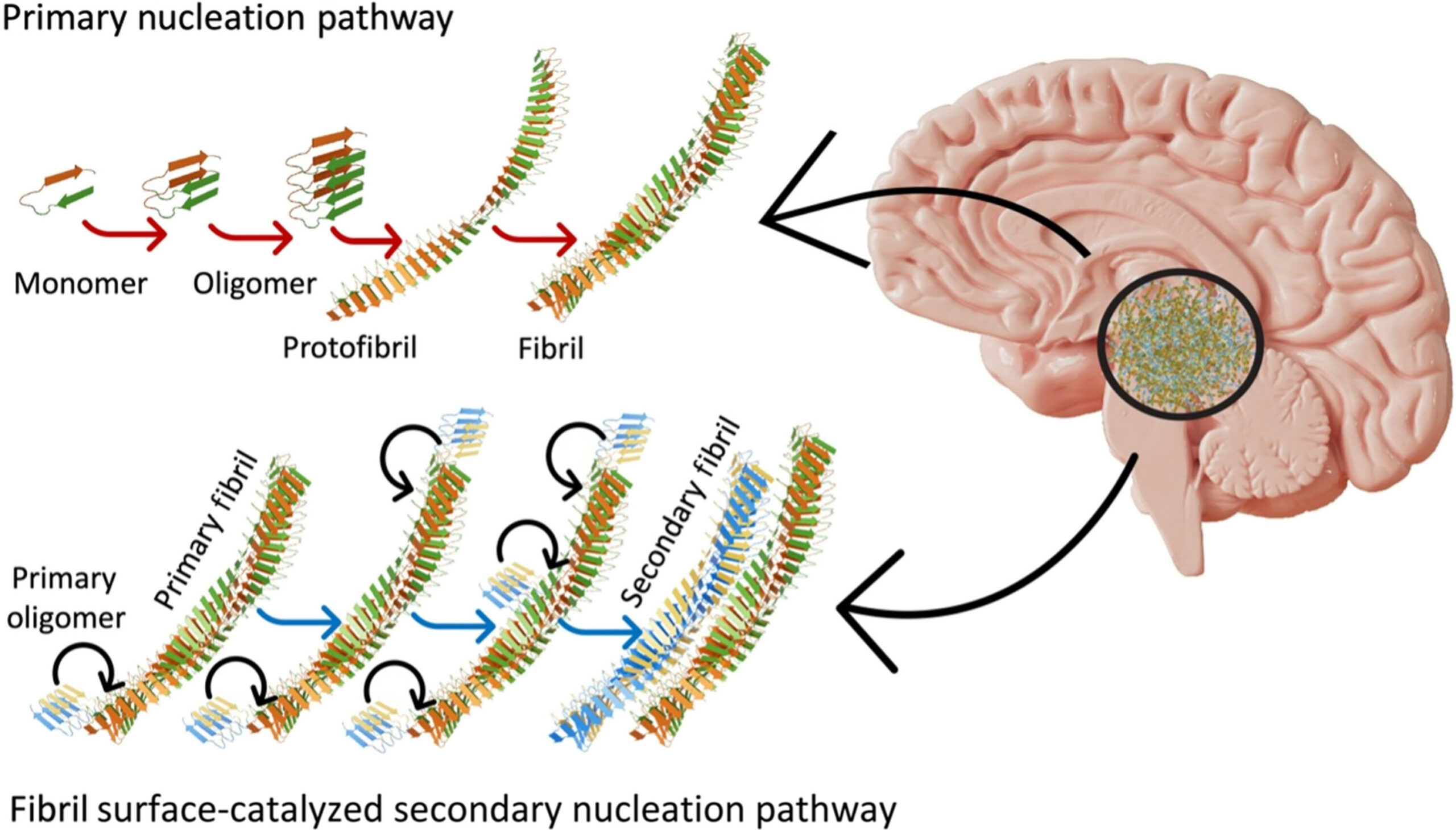
يُعد بيتا أميلويد وتاو بروتينات طبيعية تزداد في أدمغة مرضى الزهايمر مع تقدم المرض.
ومن المفهوم أن هذا جعل التكتلات البروتينية محورًا رئيسيًا في أبحاث مرض الزهايمر. ومع ذلك، وفي تناقضٍ واضح، تشير الدراسات المخبرية إلى أن تكتلات البروتين لا تلحق الضرر بخلايا الدماغ مباشرةً. ولم تكن العلاجات التي تستهدف هذه البروتينات ناجحةً بالقدر المتوقع أيضًا، مما يشير إلى أننا ما زلنا نفتقر إلى مكونات أساسية لفهم هذا المرض.
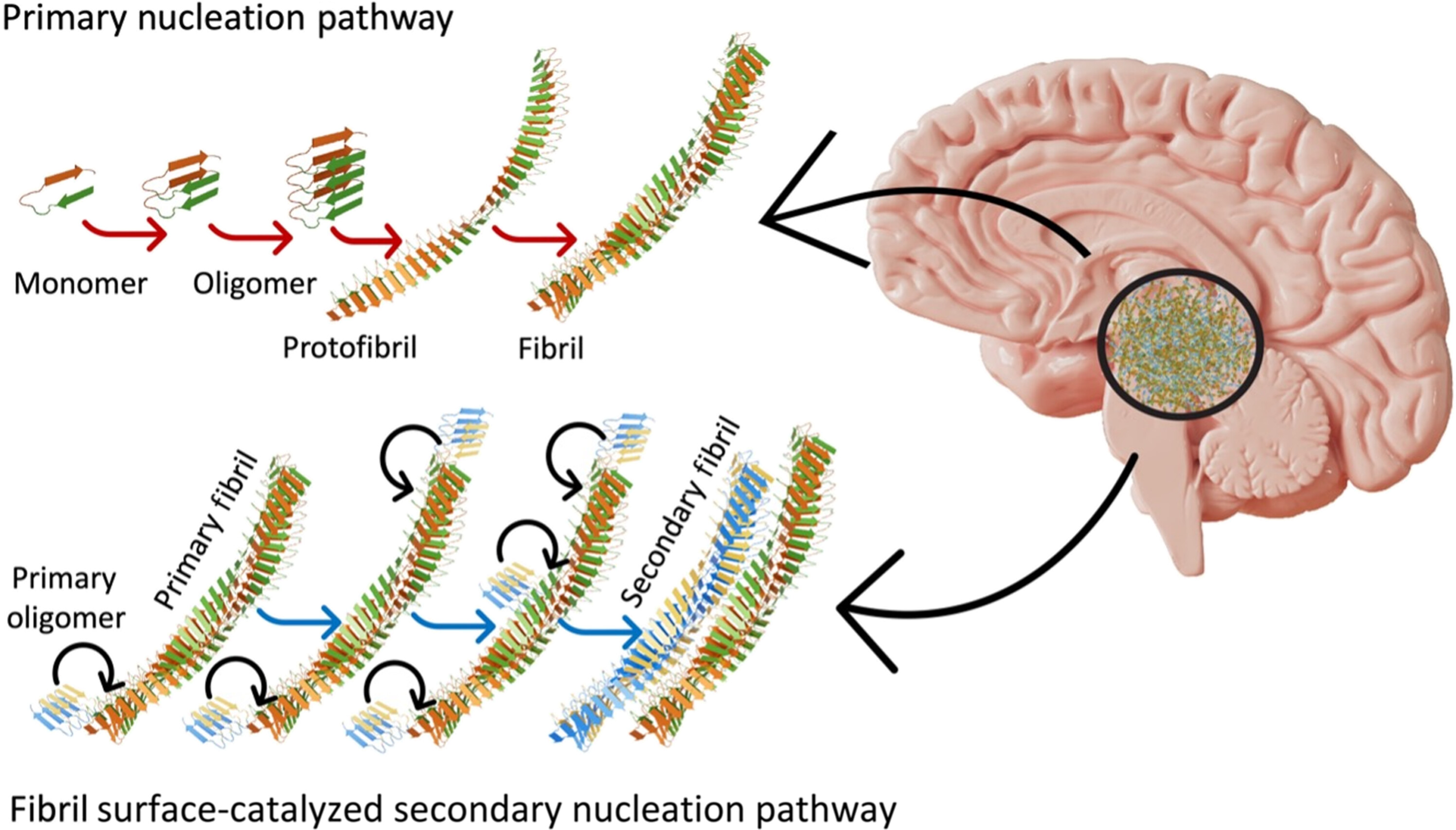
أوقف ناتالي وفريقه وظيفة إنزيم إس-أزيل ترانسفيريز في الفئران المعدلة وراثيًا للإصابة بنسخة من مرض الزهايمر للفئران.
وقد انخفضت أعراض الزهايمر سواء تم إيقاف الإنزيم وراثيًا أو مواجهته بعامل تم توصيله عبر بخاخ أنفي. كما بدا أن كل علاج يبطئ من التنكس العصبي ويمد أعمار القوارض.
ولم يكتشف الفريق أي آثار في الفئران الطبيعية التي خضعت لنفس العلاج.
يحمل العامل النشط في البخاخ الأنفي، وهو 2-بروموبالميتات، خطرًا كبيرًا بالتداخل مع عدد من العمليات، مما يجعله غير آمن للاختبار على البشر. لكن الفريق يأمل في إمكانية تحديد بديل، الآن وقد أصبح لديهم هدف محدد.
ستكون هناك حاجة إلى المزيد من الدراسات قبل أن يتمكن الباحثون من تحديد ما إذا كانت هذه تكتيكًا آمنًا. ولكن مع تشخيص جديد لمرض الخرف يتم الآن كل ثلاث ثوانٍ، وبدون علاج، هناك حاجة ماسة إلى علاجات أفضل.
سيتم اختبارُ نهجٍ جديدةٍ – يُحتملُ أنْ تُترجَمَ إلى علاجاتٍ بشريةٍ – بما في ذلك “الرقَعُ الجينية” أو البروتيناتُ المُهندسةُ التي يمكنُ أنْ تتداخَلَ مع نشاط إنزيم [نقل أسيل-S]، يقول عالمُ الأعصاب كلوديو غراسي.
تتوازى نتائجُ الفريقِ مع دراسةٍ أخرى حديثةٍ تُشيرُ أيضاً إلى أنَّ تكتلات بروتين بيتا-ألفا المُشكلةَ يمكنُ أنْ تكونَ مُشاركةً وفي نفس الوقت غير مُشاركةٍ بطريقةٍ ما في إتلاف أنسجة الدماغ حسب الجزيئات الأخرى الموجودة معها.
“حتى الآن، لم تُجرَّبْ أيُّ تدخلاتٍ علاجيةٍ تستهدفُ… [نقل أسيل-S] في مرض ألزهايمر. وبالتالي، تُضيفُ نتائجُنا طبقةً إلى فهمِ مُسببات مرض ألزهايمر، وتُحددُ أهدافاً علاجيةً محتملةً”، يستنتج ناتالي وفريقه.
نُشر هذا البحثُ في PNAS.
المصدر: المصدر