هذه بداية مقال أطول.
المحتوى: “
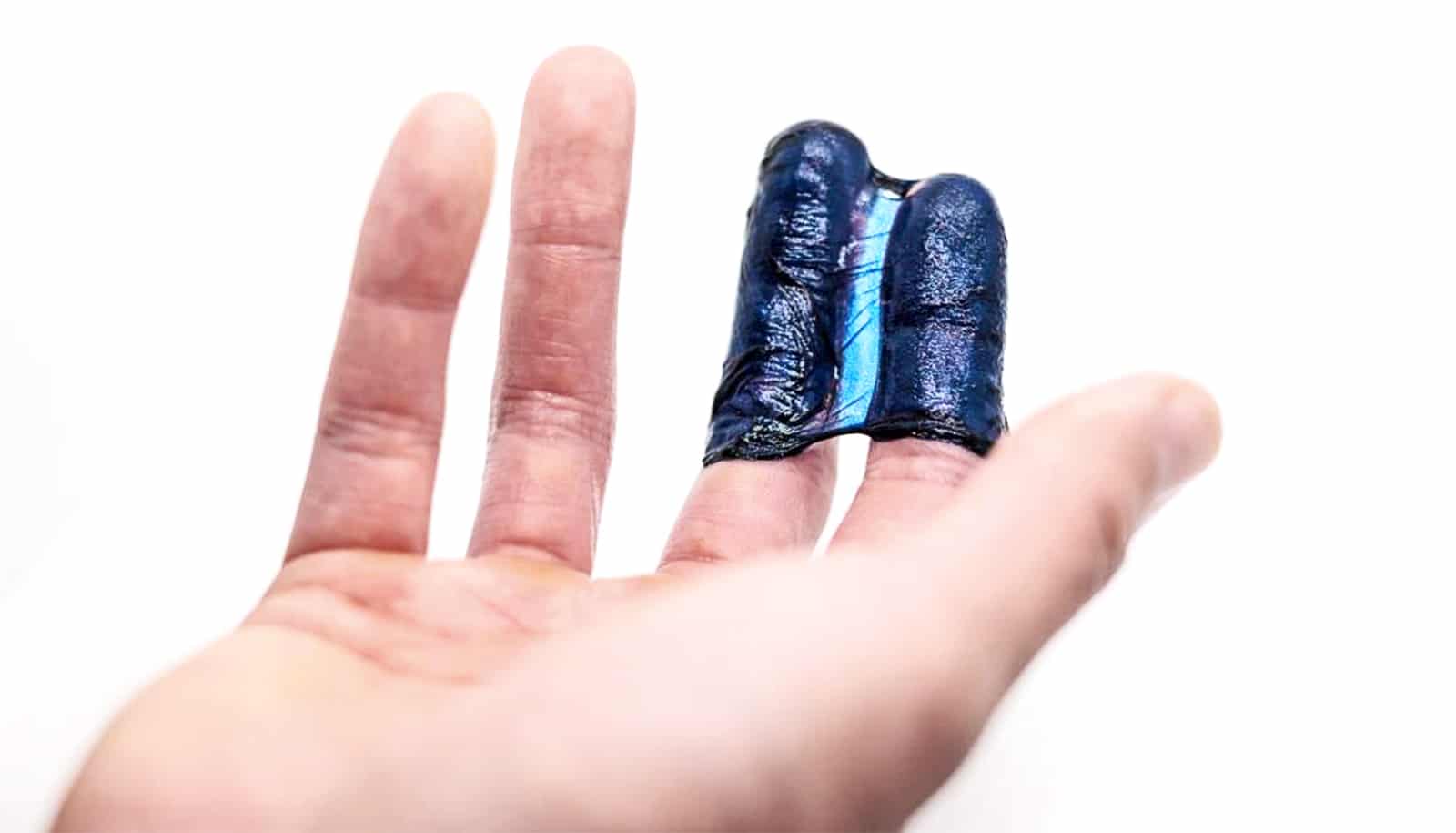
في إنجاز علميّ في مجال الإلكترونيات الحيوية، ابتكر العلماء أشباه موصلات لينة ومرنة.
إنّ المادة المثالية لتوصيل الإلكترونيات بالأنسجة الحية هي مادة لينة، قابلة للتمدد، ومحبّة للماء مثل الأنسجة نفسها: باختصار، هلام.
في الوقت نفسه، تُعرف أشباه الموصلات – وهي المواد الأساسية للإلكترونيات الحيوية مثل أجهزة تنظيم ضربات القلب، وأجهزة الاستشعار الحيوية، وأجهزة توصيل الأدوية – بأنها مواد جامدة، هشة، وكارهة للماء.
”
نشرت ورقة بحثية في Science حلّت هذا التحدي الذي حيّر الباحثين لفترة طويلة. والنتيجة عبارة عن هلام أزرق فاتح يرفرف كقنديل البحر في الماء، ولكنه يحتفظ بالقدرة شبه الموصلة الهائلة اللازمة لنقل المعلومات بين الأنسجة الحية والآلة.
هذا يعني أن مادتهم – وهي شبه موصلة وهلامية في نفس الوقت – تلبي جميع الشروط اللازمة لواجهة حيوية إلكترونية مثالية.
يقول ياو هاو داي، المؤلف الأول للورقة البحثية الجديدة: “عند صنع أجهزة حيوية إلكترونية قابلة للزرع، يجب معالجة تحدٍّ يتمثل في صنع جهاز يتمتع بخصائص ميكانيكية تشبه الأنسجة”.
“بهذه الطريقة، عندما يتم توصيله مباشرةً بالأنسجة، يمكنهما أن يتشوهان معًا، كما يشكّلان واجهة حيوية وثيقة للغاية.”
على الرغم من أن الورقة البحثية ركزت بشكل أساسي على التحديات التي تواجه الأجهزة الطبية المزروعة مثل أجهزة الاستشعار الكيميائية الحيوية وأجهزة تنظيم ضربات القلب، إلا أن داي يقول إن هذه المادة لها العديد من التطبيقات غير الجراحية المحتملة، مثل الحصول على قراءات أفضل من الجلد أو تحسين رعاية الجروح.
تقول سيهونغ وانغ، أستاذة مساعدة في كلية برتزر للهندسة الجزيئية بجامعة شيكاغو، التي قاد مختبرها البحث: “إنها تتمتع بخصائص ميكانيكية ناعمة للغاية ودرجة عالية من الترطيب مشابهة للأنسجة الحية”. هلام مسامي للغاية، لذلك يسمح بنقل الانتشار الفعال لأنواع مختلفة من العناصر الغذائية والكيماويات.
“تتحد كل هذه السمات لجعل الهلام على الأرجح المادة الأكثر فائدة في هندسة الأنسجة وتوصيل الأدوية.”
إن الطريقة النموذجية لصنع الهيدروجيل هي أخذ مادة ما، و إذابتها في الماء، وإضافة مواد جلّية لتضخيم السائل الجديد إلى شكل جل. بعض المواد تذوب ببساطة في الماء، بينما يتطلب البعض الآخر من الباحثين العبث والتعديل الكيميائي للعملية، لكن الآلية الأساسية واحدة: لا ماء، لا هيدروجيل.
ومع ذلك، فإن أشباه الموصلات لا تذوب عادةً في الماء. وبدلاً من إيجاد وسائل جديدة تستغرق وقتاً طويلاً لمحاولة إجبار العملية، أعاد الباحثون النظر في السؤال.
يقول داي: “بدأنا نفكر، ‘حسنًا، دعونا نغيّر منظورنا،’ و توصلنا إلى عملية تبادل المذيبات”.
بدلاً من إذابة أشباه الموصلات في الماء، قاموا بإذابتها في مذيب عضوي قابل للاختلاط بالماء. ثم حضّروا جلاً من أشباه الموصلات المذابة وسلائف الهيدروجيل.
من الفوائد المهمة لهذه الطريقة القائمة على تبادل المذيبات قابليتها للتطبيق على نطاق واسع لأنواع مختلفة من أشباه الموصلات البوليمرية ذات وظائف مختلفة.
إن أشباه الموصلات الهيدروجيلية، التي حصل الفريق على براءة اختراع لها ويعمل على تسويقها من خلال مركز بولسكي لريادة الأعمال والابتكار بجامعة شيكاغو، ليست عبارة عن دمج أشباه موصلات مع هيدروجيل. إنها مادة واحدة تجمع بين خصائص أشباه الموصلات والهيدروجيل في آن واحد.
يقول وانغ: “إنها قطعة واحدة فقط تجمع بين خصائص أشباه الموصلات وتصميم الهيدروجيل، مما يعني أن هذه القطعة بأكملها تشبه أي هيدروجيل آخر”.
على عكس أي هيدروجيل آخر، إلا أن المادة الجديدة حسّنت بالفعل الوظائف البيولوجية في مجالين، مما أوجد نتائج أفضل من تلك التي يمكن أن يحققها كل من الهيدروجيل أو أشباه الموصلات بمفردهما.
أولًا، فإن تماس مادة لينة للغاية مباشرةً مع الأنسجة يقلل من الاستجابات المناعية والالتهابات التي تحدث عادةً عند زرع جهاز طبي.
ثانيًا، نظرًا لأن الهيدروجيل مسامي للغاية، فإن المادة الجديدة تُمكّن من استجابة بيولوجية استشعارية مُحسّنة وتأثيرات تعديل ضوئي أقوى. وبفضل قدرة الجزيئات الحيوية على الانتشار داخل الفيلم للتفاعل، تزداد مواقع التفاعل للعلامات الحيوية قيد الكشف بشكل كبير، مما يؤدي إلى زيادة الحساسية.
بالإضافة إلى الاستشعار، تزداد الاستجابات للضوء لأداء الوظائف العلاجية على أسطح الأنسجة أيضًا من خلال نقل الجزيئات بكفاءة أكبر. وهذا يفيد وظائف مثل أجهزة تنظيم ضربات القلب التي تعمل بالضوء أجهزة تنظيم ضربات القلب أوضمادات الجروح التي يمكن تسخينها بكفاءة أكبر بنقرة ضوء للمساعدة في تسريع الشفاء.
يُمزح وانغ قائلًا: “إنها مزيج من نوع “واحد زائد واحد أكبر من اثنين”.
جاء تمويل هذا العمل من المعاهد الوطنية للصحة الأمريكية، ومكتب أبحاث البحرية الأمريكية، وصندوق جامعة شيكاغو للبداية.
المصدر: بول دالينغ لـ جامعة شيكاغو
المصدر: المصدر